Снижение уровня мочевой кислоты в сыворотке крови — основа успешного ведения пациентов с подагрой, целевые показатели определены, хотя роль мочевой кислоты в физиологических концентрациях до конца не установлена.

Высокий уровень мочевой кислоты в сыворотке — фактор риска сердечно-сосудистых заболеваний и подагры; однако роль растворимой мочевой кислоты (рМК) в физиологических концентрациях изучена плохо. Целью настоящего исследования было прояснить роль рМК в воспалении суставов. Изучали клеточные культуры первичных свиных хондроцитов и мышей с коллаген-индуцированным артритом (КИА). Было показано, что рМК подавляла индуцированную ФНО-α и интерлейкином (ИЛ)-1β экспрессию синтазы оксида азота, циклооксигеназы-2 и матриксной металлопротеиназы (ММП)-13. Изучение экспрессии мРНК нескольких ММП и агреканаз подтвердила, что рМК оказывает хондропротекторное действие путем ингибирования многих ферментов, разрушающих ткани сустава. Это способствует сохранению коллагена II типа в хондроцитах и снижает степень деградации протеогликана в хрящевых эксплантатах. Эти результаты были воспроизведены в хондроцитах, культивируемых в альгинатных микросферах. Молекулярные исследования показали, что рМК ингибирует сигнальный путь ERK/AP-1, но не IκBα-NF-κB. Повышение уровня мочевой кислоты в плазме, вызванное введением крысам с КИА оксоновой кислоты, ингибитора уриказы, привело к противовоспалительному и артропротекторному эффекту, которые проявились снижением степени тяжести артрита и соответствующими результатами иммуногистохимического анализа. Наше исследование показало, что рМК в физиологических концентрациях оказывает противовоспалительное и хондропротекторное действие как in vitro, так и in vivo.
Lai JH1,2, Luo SF1, Hung LF3, Huang CY3, Lien SB4, Lin LC4, Liu FC5, Yen BL3, Ho LJ6
Scientific Reports. 2017 May 24;7(1):2359.
PMID: 28 539 647
PMCID: PMC5443811
DOI: 10.1038/s41598−017−2 640−0
Спонсор выпуска новостей
![]()
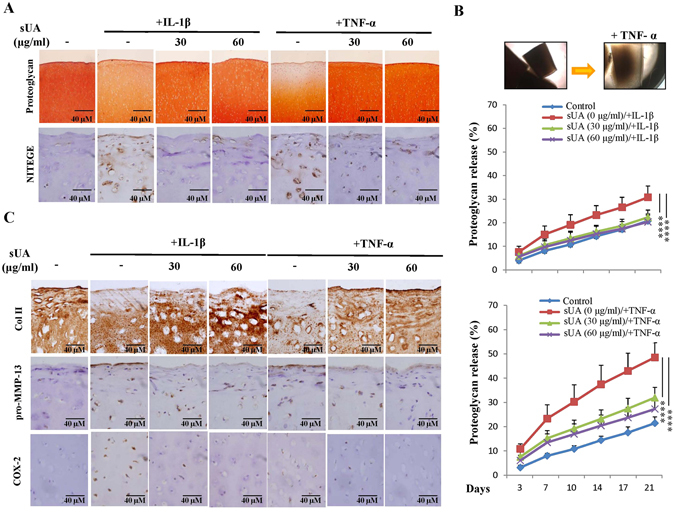
Physiological concentrations of soluble uric acid are chondroprotective and anti-inflammatory.
Abstract
High uric acid levels are a risk factor for cardiovascular disorders and gout; however, the role of physiological concentrations of soluble uric acid (sUA) is poorly understood. This study aimed to clarify the effects of sUA in joint inflammation. Both cell cultures of primary porcine chondrocytes and mice with collagen-induced arthritis (CIA) were examined. We showed that sUA inhibited TNF-α- and interleukin (IL)-1β-induced inducible nitric oxide synthase, cyclooxygenase-2 and matrix metalloproteinase (MMP)-13 expression. Examination of the mRNA expression of several MMPs and aggrecanases confirmed that sUA exerts chondroprotective effects by inhibiting the activity of many chondro-destructive enzymes. These effects attenuated collagen II loss in chondrocytes and reduced proteoglycan degradation in cartilage explants. These results were reproduced in chondrocytes cultured in three-dimensional (3-D) alginate beads. Molecular studies revealed that sUA inhibited the ERK/AP-1 signalling pathway, but not the IκBα-NF-κB signalling pathway. Increases in plasma uric acid levels facilitated by the provision of oxonic acid, a uricase inhibitor, to CIA mice exerted both anti-inflammatory and arthroprotective effects in these animals, as demonstrated by their arthritis severity scores and immunohistochemical analysis results. Our study demonstrated that physiological concentrations of sUA displayed anti-inflammatory and chondroprotective effects both in vitro and in vivo.


